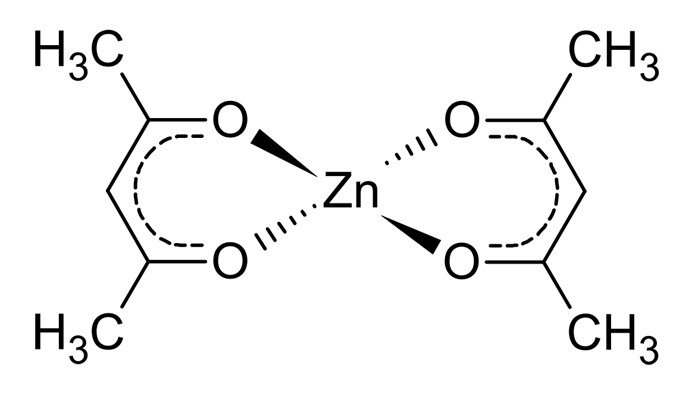
استیل استونات روی یا زینک استیل استونات Zinc acetylacetonate یک کمپلکس استیل استونات روی با فرمول شیمیایی Zn(C5H7O2)2 است.
این ترکیب در واقع یک تریمر، Zn3(acac)6 است که در آن هر یون روی توسط پنج اتم اکسیژن در یک ساختار دو هرمی مثلثی تحریف شده هماهنگ میشود.
خصوصیات زینک استیل استونات
زینک استیل استونات به صورت پودر سفید یا کرمیرنگ موجود است.
این ماده در آب نامحلول است، اما در برخی حلالهای آلی مانند کلروفرم و بنزن حل میشود.
زینک استیل استونات به عنوان یک روانکننده بسیار موثر عمل میکند و از اصطکاک بین سطوح جلوگیری میکند.
این ماده دارای پایداری حرارتی بالاست و میتواند در دماهای بالا مورد استفاده قرار گیرد.
زینک استیل استونات به دلیل نامحلول بودن در آب، خاصیت ضدآب دارد و میتواند به عنوان یک عامل مقاوم در برابر رطوبت عمل کند.
فرمول شیمیایی : C10H14O4Zn
جرم مولی : ۲۶۳٫۶۰ g·mol-1
چگالی : ۱٫۴۱ g·cm-3
نقطه ذوب ۱۲۴-۱۲۶ درجه سانتیگراد
نقطه جوش ۱۲۹-۱۳۱ درجه سانتیگراد (۱۳ hPa)
حلالیت در آب : ۶٫۹ گرم در لیتر
حلالیت : محلول در حلالهای آلی
حلالیت در آب : ۶٫۹ گرم در لیتر
حلالیت : محلول در حلالهای آلی
آماده سازی زینک استیل استونات
استیل استونات روی را می توان با واکنش سولفات روی، استیل استون و هیدروکسید سدیم به دست آورد.
استیل استونات روی یک ماده کریستالی است که کمی در آب محلول است. از طریق تصعید می توان بلورهای مونومر را به دست آورد که مونوکلینیک هستند و دارای گروه فضایی C2/c (شماره ۱۵) هستند.
کریستال های تریمریک را می توان با تصعید نیز به دست آورد، که آن هم مونوکلینیک است، با گروه فضایی C2
ساختار مونوهیدرات و دی هیدراتآن نیز شناخته شده است.
واکنش های زینک استیل استونات
هیدرات استیل استونات روی برای تهیه فیلم های مغناطیسی (Zn,Fe)Fe2O4، [۹] اکسید روی، استفاده شده است و همچنین یک کاتالیزور برای سنتز آلی است.
زینک استیل استونات (Zinc Stearate) یک ترکیب شیمیایی است که از استئاریک اسید و روی تشکیل شده است. این ترکیب در صنایع مختلف به دلیل خصوصیات فیزیکی و شیمیایی ویژهای که دارد، بسیار پرکاربرد است. در ادامه به بررسی خصوصیات و کاربردهای زینک استیل استونات میپردازیم.
کاربردهای زینک استیل استونات
زینک استیل استونات به عنوان یک روانکننده و عامل آزادکننده در فرآیند تولید پلاستیکها مورد استفاده قرار میگیرد. این ماده باعث میشود که پلاستیکها به راحتی از قالب جدا شوند و سطح نهایی آنها صاف و بدون نقص باشد.
در تولید لاستیکها، زینک استیل استونات به عنوان یک ماده نرمکننده و پایدارکننده حرارتی مورد استفاده قرار میگیرد.
به عنوان یک ماده افزودنی در محصولات آرایشی و بهداشتی مانند کرمها و لوسیونها استفاده میشود. این ماده به عنوان یک عامل ضخیمکننده و امولسیونکننده عمل میکند و باعث افزایش پایداری محصولات میشود.
زینک استیل استونات در فرمولاسیون رنگها و پوششها به عنوان یک عامل ماتکننده و روانکننده استفاده میشود. این ماده باعث بهبود توزیع رنگدانهها و افزایش یکنواختی پوشش میشود.
در تهیه برخی از داروها به عنوان یک ماده روانکننده و پایدارکننده مورد استفاده قرار میگیرد.